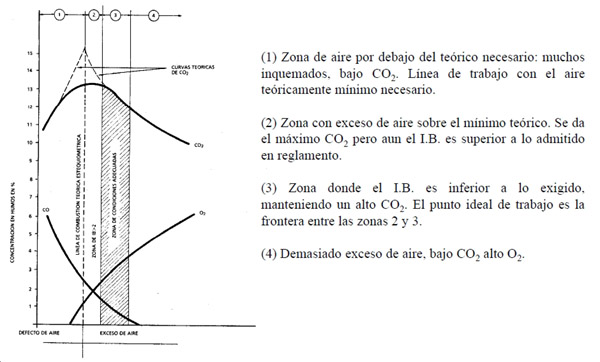
•
Combustión completa: es aquella
reacción en la que el combustible se quema hasta
el máximo grado posible de oxidación. En consecuencia,
no habrá sustancias combustibles en los humos. En
los productos de la combustión se puede encontrar
n2, CO2, H2O y SO2.
• Combustión incompleta: es
aquella reacción en la que el combustible no se oxida
completamente. Se forman sustancias, denominadas inquemados,
que todavía pueden seguir oxidándose, por
ejemplo, CO. Otros inquemados pueden ser H2, CnHm, H2S y
C. Estas sustancias son los contaminantes más comunes
que escapan a la atmósfera en los gases de combustión.
• Combustión teórica o estequiométrica:
es la combustión realizada con la cantidad teórica
de oxígeno estrictamente necesaria para producir
la oxidación total del combustible sin que se produzcan
inquemados. En consecuencia, no se encuentra O2 en los humos,
ya que el O2 aportado a la combustión se consume
completamente en la misma.
• Combustión con exceso de aire:
es la combustión que se lleva a cabo con una cantidad
de aire superior a la estequiométrica. Esta combustión
tiende a no producir inquemados y es típica la presencia
de O2 en los humos. Si bien la incorporación de aire
permite evitar la combustión incompleta y la formación
de inquemados, trae aparejada la pérdida de calor
en los productos de combustión, reduciendo la temperatura
de combustión, la eficiencia y la longitud de llama.
• Combustión con defecto de aire:
en esta combustión, el aire disponible es menor que
el necesario para que se produzca la oxidación total
del combustible. Por lo tanto, se producen inquemados.
•
Coeficiente de exceso de aire: es la relación
entre el volumen de aire aplicado a una combustión
y el volumen preciso para una combustión estequiométrica.
Se representa mediante un número adimensional (n)
cuyo valor puede ser:
n = 1: aire preciso para una combustión estequiométrica.
n < 1: defecto de aire, se dice que la mezcla es rica
y la combustión incompleta.
n > 1: exceso de aire, se dice que la mezcla es pobre
y la combustión puede ser completa.
Conseguir una mezcla perfecta entre combustible y comburente
para obtener una combustión completa con una relación
estequiométrica de masas entre ellos es muy difícil,
por lo que habitualmente se incorpora un exceso de aire
a la combustión. Esto evita la producción
de inquemados, en especial el monóxido de carbono,
aun cuando este exceso produce una reducción del
rendimiento de combustión al tener que calentar un
mayor volumen de aire, en especial sus inertes (n2) que
se evacuan con los productos de la combustión.